|
Aufgabe 3: Reaktionsgeschwindigkeit
eines Enzyms - Vorbemerkungen
Wenn Gerste, z. B. in einer Mälzerei
zum Keimen gebracht wurde, kann man anschließend mit Wasser
ein sogenanntes Malzextrakt herstellen, der ca. 40 - 50% Maltose
(ein Disaccharid aus Glukose und Fructose) enthält. Im Gerstenkorn
werden durch das Quellen im Wasser Lebensprozesse angekurbelt, bei
denen auch Eiweißstoffe entstehen, die dafür verantwortlich
sind, dass die Reservestärke des Gerstenkorns schon bei Temperaturen
unter 40o C in Maltose gespalten wird. Die Stärkespaltung,
die bei Zimmertemperatur normalerweise unmessbar langsam verläuft,
wird dabei durch das Protein (den Eiweißstoff) beschleunigt,
es wirkt als Katalysator . Proteine mit einer solchen katalytischen
Wirkung nennt man Enzyme .
Man kann die Enzyme auch als Biokatalysatoren bezeichnen.
Die von den Enzymen umgesetzten Moleküle (hier: Stärke)
nennt man das Substrat. (Quelle zum Text und zu den beiden folgenden
Darstellungen: Materialien für die Sekundarstufe II. Biologie.
Stoffwechselphysiologie, Neubearbeitung. Hrsg. u. bearb. v. K.-H.
Scharf u. a., Hannover 1999, S. 22f.)
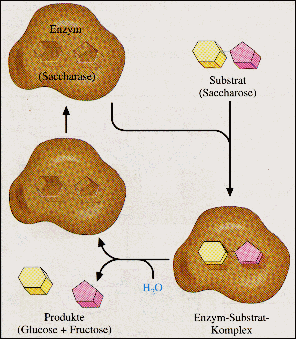 Enzymwirkung am Beispiel der Saccharose-
Enzymwirkung am Beispiel der Saccharose-
spaltung durch Saccharase |
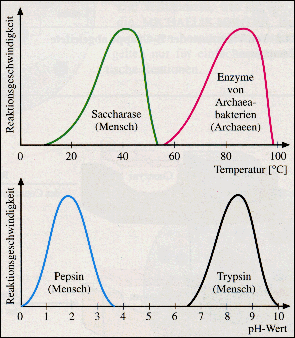 Wirkung von Temperatur und pH-Wert
Wirkung von Temperatur und pH-Wert
auf die Enzymreaktion |
Wie bei allen chemischen Reaktionen
nimmt auch bei enzymatischen Reaktionen die Reaktionsgeschwin-digkeit
mit der Erhöhung der Temperatur zu. Ab einem bestimmten
Punkt, dem Temperaturoptimum,
geht die Reaktionsgeschwindigkeit allerdings zurück. Das Eiweißmolekül
beginnt, wie alle Eiweißmoleküle, seine räumliche
Struktur zu verändern, also zu denaturieren: das Enzym
verliert seine katalytische Eigenschaft. Bei welchen Temperaturen
dies geschieht, ist dabei von Enzym zu Enzym verschieden.
Für Organismen bedeutet dies, dass es eine obere Grenze
der Temperatur gibt, die nicht überschritten werden darf, da
dann wichtige Enzyme ausfallen können. Dies erklärt somit
die Gefahr zu hohen Fiebers (beim Menschen bei einer Temperatur
von über 42o C ).
 Hier
geht es weiter! Hier
geht es weiter!
|
|

